Специалисты Юго-Западного университета обнаружили "ахиллесову пяту" рака яичников, а также новые биомаркеры, которые могут указать на то, какие пациенты являются лучшими кандидатами на применение новых методов лечения.
Результаты исследования, опубликованные в журнале Cell, были частично получены с помощью исследовательского инструментария, изобретенного в лаборатории UT Southwestern.
"Многие исследователи пытаются найти взаимосвязи в раковых опухолях, задаваясь вопросом, почему раковая клетка усиливает тот или иной ген, повышает уровень белка или регулирует критический клеточный путь. Эти изменения дают раку селективное преимущество, но в то же время они могут стать "ахиллесовой пятой" - чем-то, что, если бы изменение было заблокировано, уничтожило бы рак или остановило его рост", - сказал в интервью Science Daily руководитель исследования Ли Краус.
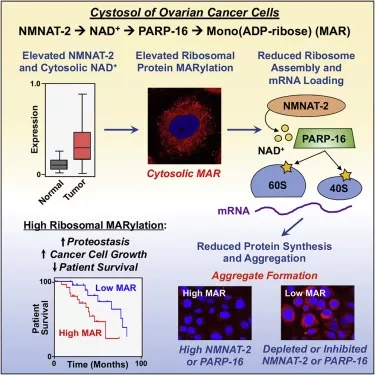
Краус и его сотрудники обнаружили, что рак яичников значительно усиливает фермент NMNAT-2, который производит NAD+. NAD+ является субстратом для семейства ферментов под названием PARPs, которые химически модифицируют белки с помощью АДФ-рибозы из NAD+. В этом исследовании специалисты обнаружили, что один из членов семейства PARP, PARP-16, использует NAD+ для модификации рибосом - белковых синтезирующих машин клетки.
Сложность этой работы заключалась в том, что одну группу АДФ-рибозы, присоединенную к белку, трудно обнаружить. Краус и его коллеги решили эту проблему, разработав синтетический реагент для обнаружения моно(ADP-рибозы), состоящий из естественных белковых доменов, соединенных вместе, который можно использовать для обнаружения ADP-рибозилированных белков в клетках и образцах пациентов. В сотрудничестве с клиницистами UT Southwestern Краус и его группа проверили образцы пациентов с раком яичников с помощью реагента для обнаружения моно(АДФ-рибозы), чтобы выявить тех, у кого уровень моно(АДФ-рибозы) понижен или повышен.
"Мы смогли показать, что когда рибосомы моно(АДФ-рибозил)ируются в клетках рака яичников, модификация изменяет способ трансляции мРНК в белки", - рассказывает Краус. "Раковые клетки яичников усиливают NMNAT-2, чтобы повысить уровень NAD+, доступного для PARP-16 для моно(ADP-рибозил)азы рибосом, что дает им селективное преимущество, позволяя им точно регулировать уровень трансляции и предотвращать токсичную агрегацию белков. Но это селективное преимущество также становится их ахиллесовой пятой. Они зависимы от NMNAT-2, поэтому ингибирование или уменьшение NMNAT-2 подавляет рост раковых клеток".
Это исследование выявило моно(АДФ-рибозу) и NMNAT-2 как потенциальные биомаркеры рака яичников, что может позволить клиницистам определить, какие пациенты с раком яичников могут положительно отреагировать, а какие нет. Еще больше пациентов с раком яичников могут добиться хороших результатов, если будет разработан ингибитор для PARP-16, который блокирует рибосомную моно(АДФ-рибозил)ацию. Краус, являясь экспертом по PARPs, говорит, что медицинская наука добилась большого успеха в разработке одобренных FDA ингибиторов PARP-1, и вполне вероятно, что будет разработан ингибитор для PARP-16.
"В настоящее время ингибиторы PARP-16 не проходят клинических испытаний, но лаборатории в научных кругах и фармацевтической промышленности разрабатывают специфические и мощные ингибиторы PARP-16. Такой препарат может стать эффективной терапией для лечения рака яичников",
- сказал он. Краус является основателем и консультантом компаний Ribon Therapeutics Inc. и ARase Therapeutics Inc. Он также является одним из владельцев патента США на реагент для обнаружения моно(ADP-рибозы), который был лицензирован и продается компанией EMD Millipore.
Исследование Крауса - это не просто большой прогресс в фундаментальной науке. Оно имеет реальные перспективы для исследователей-клиницистов и практических врачей, занимающихся лечением рака, поскольку показывает биомаркер и путь, на который может быть нацелена будущая лекарственная терапия.
Sridevi Challa et al. АДФ-рибозилирование рибосом подавляет трансляцию и поддерживает протеостаз в раковых опухолях (аннотация).
Дефекты трансляции приводят к изменениям в экспрессии белков, которые могут служить движущей силой формирования рака. В данном исследовании мы показали, что цитозольный синтез NAD+ играет важную роль в развитии рака яичников, регулируя трансляцию и поддерживая гомеостаз белков. Экспрессия NMNAT-2, цитозольной NAD+ синтазы, сильно повышена при раке яичников. NMNAT-2 поддерживает каталитическую активность моно(ADP-рибозил)трансферазы (MART) PARP-16, которая моно(ADP-рибозил)атезирует (MARилирует) рибосомальные белки. Деплеция NMNAT-2 или PARP-16 приводит к ингибированию MARиляцию, увеличению ассоциации полисом и усилению трансляции специфических мРНК, агрегации их транслированных белковых продуктов и снижению роста клеток рака яичников. Кроме того, MARиляция рибосомных белков, таких как RPL24 и RPS6, ингибирует сборку полисом путем стабилизации связывания eIF6 с рибосомами.
В совокупности наши результаты показывают, что MARиляция рибосом способствует белковому гомеостазу в раковых клетках путем точной настройки уровня синтеза белка и предотвращения агрегации токсичных белков.