Биомаркеры - это компоненты, которые могут присутствовать в биологических образцах и связаны с определенными заболеваниями.
Поэтому врачи могут анализировать биологические образцы пациента, чтобы проверить состояние его здоровья или проследить за ходом конкретной терапии. Как правило, перед анализом эти образцы необходимо очистить и разбавить, и современные методы медицинской диагностики полагаются на медицинские учреждения и лаборатории для проведения этих рутинных анализов. Это длительный процесс, требующий обученного персонала и дорогостоящего оборудования для извлечения, транспортировки, хранения, обработки и анализа образцов в централизованных учреждениях. Более того, в период глобального кризиса, подобного текущей пандемии, давление тысяч запросов на проведение тестов может перегрузить и подорвать систему здравоохранения.
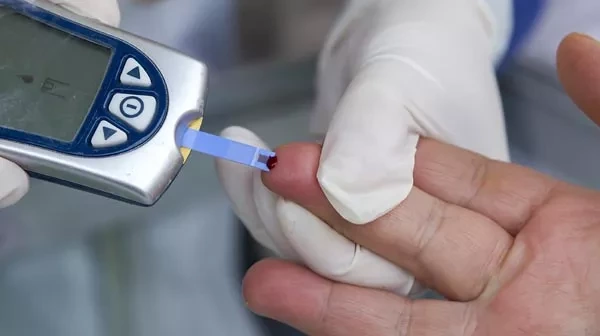
С другой стороны, устройства point-of-care, представляющие собой небольшие автоматизированные приборы, способны проводить диагностику в децентрализованных местах и быстро давать ответы. Одним из примеров такого устройства является глюкометр, который люди с диабетом используют для контроля уровня сахара в крови. Эти устройства могут преодолеть ограничения, связанные с необходимостью обработки образцов через централизованную систему, что дает возможность любому человеку следить за своим здоровьем из дома, просто используя крошечный образец крови, полученный с помощью укола пальцем.
Однако разработка этих устройств сопряжена с техническими трудностями, связанными с измерением биологических образцов. Биомаркеры некоторых заболеваний и инфекций присутствуют в образцах в очень малых количествах, что, в свою очередь, ставит задачу разработки чрезвычайно чувствительных методов обнаружения. Хотя увеличение площади поверхности биосенсора может повысить чувствительность прибора, эти поверхности имеют тенденцию быстро засоряться и загрязняться, делая их непригодными для использования.
С этой целью команда под руководством профессора Чо Юн Кёна из Института фундаментальной науки, Южная Корея, недавно разработала биосенсор, используя метод создания наноструктурированных и нанопористых поверхностей. Эта комбинированная стратегия не только обеспечивает датчику беспрецедентную чувствительность, но и делает его устойчивым к загрязнению белками.
Хотя ранее не было известно способа надежного создания электродов с использованием таких наноструктурированных и нанопористых подложек, команда исследователей сообщила о простом методе создания таких материалов. Принцип основан на воздействии электрических импульсов на плоскую поверхность, покрытую золотом, в присутствии поваренной соли и сурфактанта, который может образовывать мицеллы в растворе. Эти электрические импульсы вызывают желаемую реакцию травления и повторного осаждения золота с поверхности и, в свою очередь, рост наноструктур и формирование нанопор. Использование сурфактанта в форме мицелл имеет важное значение для успеха этой стратегии, поскольку он предотвращает диффузию материала во время процесса, что позволяет повторно осаждать его.
Формирование этих наноструктур позволило получить большую площадь поверхности, что оказалось полезным для повышения чувствительности анализов, в то время как формирование подложек с нанопорами было идеальным для предотвращения загрязнения биологических образцов. Совокупность преимуществ наноструктур и нанопор стала залогом успеха данной стратегии, которая может быть применена для прямого анализа клинических образцов плазмы.
Далее исследователи продемонстрировали эту новую технологию, создав биосенсор для обнаружения рака простаты. Электрод был достаточно чувствителен, чтобы отличить группу больных раком простаты от здоровых доноров, используя лишь небольшое количество образцов плазмы плазмы крови или мочи. При этом не использовалось никаких этапов разбавления или предварительной обработки, что означает, что технология может быть легко использована для point-of-care диагностики рака.
Профессор Чо отметил: "Мы считаем, что эта технология необходима для будущего развития приборов и диагностических тестов, работающих с биологическими образцами. Способность обнаруживать низкие концентрации соответствующих биомаркеров с надежной производительностью открывает двери для возможностей в области диагностики рака, патогенов и других заболеваний". Результаты этого исследования были опубликованы в журнале Advanced Materials.
Jonathan Sabaté del Río et al. SEEDING позволяет проводить чувствительное электрохимическое обнаружение биомаркеров в неразбавленных биологических образцах (аннотация).
Электрохимические биосенсоры продемонстрировали большой потенциал для создания простых, быстрых и экономически эффективных диагностических инструментов, используемых в медицинских учреждениях. Однако прямой анализ сложных биологических жидкостей, таких как плазма, был ограничен потерей чувствительности, вызванной биоконтаминацией. Увеличивая площадь поверхности, наноструктурированный электрод может повысить чувствительность обнаружения. Однако, подобно обоюдоострому мечу, большая площадь поверхности увеличивает неспецифическую адсорбцию контаминирующих белков. Использование нанопористых структур может предотвратить загрязнение белками. Однако не существует прямого подхода к созданию наноструктурированных и нанопористых поверхностей, совместимых с тонкопленочными электродами.
В настоящем исследовании демонстрируется преимущественное травление хлорида и анизотропное восстановление золота с помощью поверхностноактивных веществ для создания однородных, наноструктурированных и нанопористых золотых электродов, что позволяет увеличить площадь поверхности в 190 ± 20 раз в течение одной минуты без использования матриц. Этот процесс, "взаимодействие электрохимического травления с осаждением для роста наноструктуры/нанопоры" (SEEDING), на электродах повышает чувствительность и противоконтаминирующие возможности амперометрических биосенсоров, позволяя напрямую анализировать опухолевые внеклеточные везикулы (tEVs) в сложных биожидкостях с пределом обнаружения 300 tEVs µL-1 из неразбавленной плазмы и хорошо отличать пациентов с раком простаты от здоровых с площадью под кривой 0. 91 в образцах мочи и 0,90 в образцах плазмы.