Изменения клеточного метаболизма защищают макрофаги от перегрузки и тем самым способствуют преодолению воспалительных реакций.
Новые данные исследовательской группы из Университета Фридриха-Александра в Эрлангене-Нюрнберге показывают, как воспалительные реакции могут быть преодолены путем изменения метаболизма макрофагов. В этом процессе играют роль опасные сигналы, выделяемые поврежденными клетками во время воспаления. "Переподключение" митохондрий в макрофагах защищает их от перегрузки и, таким образом, может улучшить способ устранения частей поврежденных клеток и снять воспалительную реакцию. Результаты исследования были недавно опубликованы в журнале Immunity.
Воспаление - это естественная и жизненно важная реакция нашей иммунной системы на сигналы опасности и повреждение тканей. Воспалительные процессы помогают организму устранить триггеры, например, бактерии, и запустить механизмы восстановления. Однако быстрое и скоординированное прекращение воспалительной реакции не менее важно, поскольку в противном случае существует риск развития хронических воспалительных заболеваний, таких как ревматоидный артрит или болезнь Крона. Одним из важных факторов для снятия воспалительной реакции является уничтожение поврежденных и мертвых клеток - процесс, который до сих пор был не очень хорошо изучен. Если позволить этим клеткам накапливаться, может возникнуть новое воспаление.
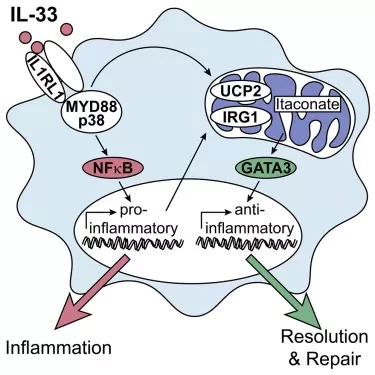
Исследовательская группа смогла лучше понять фундаментальные молекулярные механизмы воспаления, изучая функцию макрофагов в месте возникновения воспаления. Эти клетки способны поглощать большое количество клеточных отходов, переваривать и выводить молекулярные компоненты этих отходов в своих митохондриях. Ученые смогли продемонстрировать, что опасный сигнал интерлейкина 33, который высвобождается из поврежденных клеток, вызывает длительные изменения в метаболизме макрофагов, так что их способность утилизировать отходы значительно возрастает. Огромное количество отходов, образующихся во время воспалительной реакции, подвергает митохондрии серьезной нагрузке, в результате чего они производят повышенное количество повреждающих кислородных радикалов. Интерлейкин 33 регулирует функцию митохондрий, инициируя в этих клеточных компонентах процесс, известный как разобщение (uncoupling), и защищая их от перегрузки.
"Это позволяет макрофагам "выпустить пар" и продолжить поглощение отходов без перерыва, несмотря на большую нагрузку на них, в результате чего устраняются процессы воспаления",
- объясняет Мария Фаас, ведущий автор статьи.
Выводы, сделанные исследователями, могут проложить путь к новым подходам к лечению хронических воспалительных заболеваний. "Возможно, удастся ускорить и поддержать преодоление воспалительных процессов в долгосрочной перспективе, воздействуя на клеточный метаболизм макрофагов и намеренно отключая их митохондрии", - объясняет Фаас. Интересно, что вещества, положительно влияющие на клеточный метаболизм макрофагов, уже открыты. Однако они еще не одобрены для применения при хронических воспалительных заболеваниях и должны пройти дополнительные клинические испытания.
Maria Faas et al. IL-33-индуцированное метаболическое перепрограммирование контролирует дифференциацию альтернативно активированных макрофагов и устранение воспаления (аннотация).
Альтернативно активированные макрофаги (ААМ) способствуют снятию воспаления и восстановлению тканей. Однако молекулярные пути, регулирующие их дифференцировку, остаются не до конца изученными. В данном исследовании мы показываем, что опосредованное митохондриальное перепрограммирование с помощью разобщающего белка-2 и транскрипционного фактора GATA3 специфически контролирует дифференцировку про-восстановительных ААМ в ответ на алармин IL-33. В макрофагах IL-33 последовательно запускал раннюю экспрессию провоспалительных генов и последующую дифференциацию в ААМ.
Глобальный анализ основных сигнальных событий показал, что IL-33 индуцировал быструю метаболическую перестройку макрофагов, которая включала отключение дыхательной цепи и повышенное производство метаболита итаконата, что впоследствии вызвало GATA3-опосредованную поляризацию AAM. Условное удаление GATA3 в мононуклеарных фагоцитах соответственно отменяло IL-33-индуцированную дифференцировку AAMs и восстановление тканей при мышечной травме.
Таким образом, наши данные выявили IL-4-независимый и GATA3-зависимый путь в мононуклеарных фагоцитах, который возникает в результате перестройки митохондрий и контролирует пластичность макрофагов и устранение воспаления.