Т-клетки составляют основную часть нашей иммунной защиты, предохраняя нас от постоянного шквала потенциально патогенных возбудителей в окружающей среде.
Иммунологи из Университета Монаша открыли новые данные о тонкостях активации Т-клеток при встрече с такими патогенными угрозами. В исследовании, опубликованном в журнале Science, группа под руководством Николь Ла Грута обнаружила, что для создания надежного активирующего сигнала Т-клетки должны прикрепляться к патогенам, таким как вирусы, в определенной ориентации. Рецепторы Т-клеток на поверхности этих иммунных клеток прикрепляются к фрагментам антигенов, представленных на поверхности инфицированных клеток. Это критическое событие распознавания запускает каскад молекулярных событий, ведущих к разрушению и уничтожению инфицированной клетки.
"Основная проблема заключается в том, что в организме человека существуют миллионы различных Т-клеточных рецепторов (TCR) и огромное количество вирусов, что затрудняет понимание правил, по которым распознавание вируса Т-клеточным рецептором приводит к активации Т-клеток. Действительно, эта проблема остается дискуссионной уже более 25 лет", - пояснила Ла Грута.
Используя набор экспериментальных технологий, включая микроскопию со сверхразрешением, биохимические анализы и модели in vitro на животных, Ла Грута и ее коллеги обнаружили, что ориентация, в которой TCR связывается со своей мишенью, определяет, активирована ли Т-клетка. "Это прогресс в нашем фундаментальном понимании того, как Т-клетки должны "увидеть" патогенные антигены, чтобы активироваться", - говорит Ла Грута.
"Это позволило прояснить критический механизм, необходимый для эффективного Т-клеточного иммунитета. Это также имеет значение для текущей разработки иммунотерапии, направленной на усиление активации Т-клеток".
Pirooz Zareie et al. Каноническая стыковка Т-клеточного рецептора с пептидом-MHC необходима для Т-клеточной сигнализации (аннотация).
Распознавание Т-клеточным рецептором (TCR) пептидов-главных комплексов гистосовместимости (pMHC) является одним из самых разнообразных взаимодействий рецептор-лиганд в биологии. Тем не менее, эти взаимодействия демонстрируют высоко консервативную, или каноническую, полярность стыковки TCR-pMHC как у мышей, так и у людей. Вопрос о том, обусловлена ли эта каноническая полярность стыковки эволюционно сохраненной, кодируемой генетически линией (germline-encoded) комплементарностью между TCR и MHC или сигнальными ограничениями, накладываемыми корецепторами, является предметом продолжительных дебатов. В данном исследовании мы продемонстрировали, что хотя TCR-распознавание MHC с обратной полярностью преобладает в репертуаре наивных, специфичных к вирусным эпитопам Т-клеток и может демонстрировать относительно высокую аффинность к pMHCI, такие TCR не способны поддерживать TCR-сигнализацию в присутствии корецептора CD8 из-за неправильной локализации Lck. Эти данные подтверждают парадигму, в которой высококонсервативная полярность стыковки TCR-pMHCI определяется структурными ограничениями на TCR-сигнализацию.
Имеющиеся данные свидетельствуют о том, что каноническая полярность стыковки TCR-pMHC обусловлена эволюционно жестким подключением комплементарных генетически кодируемых (germline-encoded) мотивов на интерфейсе TCR и MHC. Альтернативная модель предполагает, что распознавание TCR pMHC во время тимического отбора определяется необходимостью корецепторов CD4 или CD8 связывать MHC и доставлять связанный с корецептором Lck к сигнальному комплексу CD3. Ранее мы идентифицировали реверсивно-полярные TRBV17+ TCR из доиммунного репертуара вируса гриппа А (IAV), которые связывали pMHCI (H-2DbNP366) с умеренной аффинностью, но не могли поддерживать надежное привлечение Т-клеток. В данной работе, используя ряд канонических и реверсивных TCR, специфичных для одного и того же когнатного pMHCI, мы проверили гипотезу о том, что полярность стыковки TCR-pMHCI предшествует силе связывания в качестве ключевого фактора, определяющего активацию Т-клеток. Мы предположили, что основополагающим фактором канонической полярности стыковки является колокализация сигнальных молекул, центральных для пути трансдукции сигнала TCR.
Результаты
В данном исследовании мы продемонстрировали, что реверсивные TCR преобладают в наивном вирусоспецифическом репертуаре, но слабо представлены в иммунном ответе после вирусного воздействия. Мы определили антиген-специфические TCRαβ-клонотипы, которые либо плохо рекрутировались, либо клонированно расширялись, и обнаружили преимущественную связь между иммунной распространенностью и канонической стыковкой TCR-pMHCI. Это не зависело от аффинности pMHCI, образования захватывающих или скользящих связей или кластеризации TCR, что свидетельствует о том, что для активации Т-клеток необходима каноническая полярность стыковки. Этот вывод был подтвержден после вирусного заражения адоптивно перенесенных ретрогенных Т-клеток, экспрессирующих реверсированные или канонические стыковочные TCR с различной аффинностью.
Неспособность Т-клеток, экспрессирующих TCR с обратной стыковкой, рекрутироваться в противовирусный иммунный ответ демонстрирует, что топология стыковки TCR-pMHCI превосходит аффинность TCR-pMHCI в качестве основного фактора, определяющего эффективное рекрутирование иммунитета in vivo. Используя микроскопию с визуализацией флуоресценции (FLIM)-фёрстеровский резонансный перенос энергии (FRET), мы показали, что каноническая стыковка TCR-pMHCI необходима для колокализации CD8-Lck с CD3ζ, которая нарушается, когда TCR связывается с pMHCI с обратной полярностью. Требование канонической стыковки TCR-pMHCI может быть обойдено путем удаления корецептора CD8 или диссоциации Lck от CD8, что позволяет предположить, что секвестрация Lck корецептором CD8 играет двойную роль: потенцирует сигнализацию, возникающую в результате канонических взаимодействий TCR-pMHCI, и препятствует сигнализации TCR-pMHCI с обратной полярностью.
Заключение
Неспособность TCR с обратной полярностью участвовать в иммунном ответе происходит независимо от аффинности связывания TCR-pMHCI и является прямым следствием обратного взаимодействия TCR-pMHCI. Большинство обнаруженных на сегодняшний день комплексов TCR-pMHC, на основе которых была создана каноническая парадигма стыковки TCR-pMHCI, были получены из расширенного иммунного репертуара. Таким образом, мы пришли к выводу, что высококонсервативная полярность стыковки определяется преимущественно структурными ограничениями, налагаемыми на TCR-сигнализацию и рекрутирование в иммунный ответ. Помимо общепризнанного усиления сигнализации в результате канонического взаимодействия TCR-pMHCI, наши результаты свидетельствуют о роли ассоциации корецептор-Lck в предотвращении сигнализации в результате неканонического распознавания TCR-pMHC. Такая негативная регуляция может служить для ограничения степени функциональной перекрестной реактивности TCR и сдерживания числа сигнальнокомпетентных TCR-связывающих модальностей.
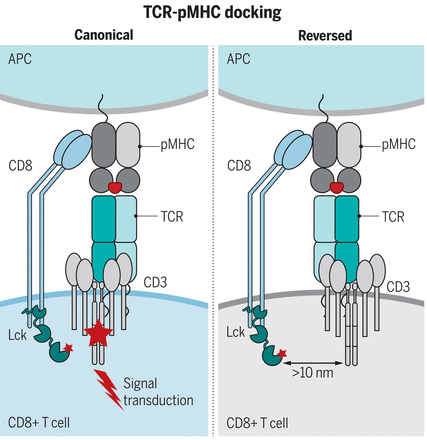
Каноническая полярность стыковки TCR-pMHC необходима для колокализации CD3 и корецептор-ассоциированного Lck и для продуктивного TCR-сигналинга. Pirooz Zareie et al. Canonical T cell receptor docking on peptide–MHC is essential for T cell signaling