Из примерно 20 000 человек в только США, у которых в этом году будет диагностирован рак пищевода, только 4 000, вероятно, останутся в живых в 2027 году.
Такие ужасающие данные уже давно побуждают исследователей пытаться понять корни этого заболевания, но они мало что обнаружили - до сих пор.
Группа исследователей из Комплексного онкологического центра Кейса считает, что им удалось выявить сигнальный путь клеток, ответственный за развитие аденокарциномы пищевода - агрессивной формы рака пищевода, которая постепенно становится все более распространенной даже среди молодых людей.
"За последние несколько десятилетий заболеваемость раком пищевода выросла в несколько раз, что делает его наиболее распространенной злокачественной опухолью пищевода в США. Как и рак желудка и поджелудочной железы, это очень агрессивные злокачественные опухоли, которые могут быть устойчивы к лечению, с неутешительными показателями выживаемости и отсутствием эффективных целевых методов лечения", - рассказывает соавтор работы Кишор Гуда.
Новое исследование, опубликованное в этом месяце в журнале Gastroenterology, объясняет, как важный молекулярный механизм, известный ученым как "тирозинкиназный путь Ephrin B2 (EphB2)", активируется во время развития аденокарциномы пищевода и способствует росту рака. Результаты исследования также показывают, что механизм EphB2 контролирует рост раковых клеток и одновременно регулирует поведение нормальных клеток пищевода.
"С молекулярной точки зрения, EphB2 индуцирует уровни общепризнанного проракового гена, называемого c-MYC. Один из механизмов, с помощью которого EphB2, по-видимому, влияет на уровень MYC, заключается в его прямом взаимодействии с белком, известным как MYCBP2, который является супрессором активности MYC", - объясняет Гуда.
"Это первое известное нам открытие, демонстрирующее регулирование MYC с помощью EphB2 и его физическое взаимодействие с MYCBP2".
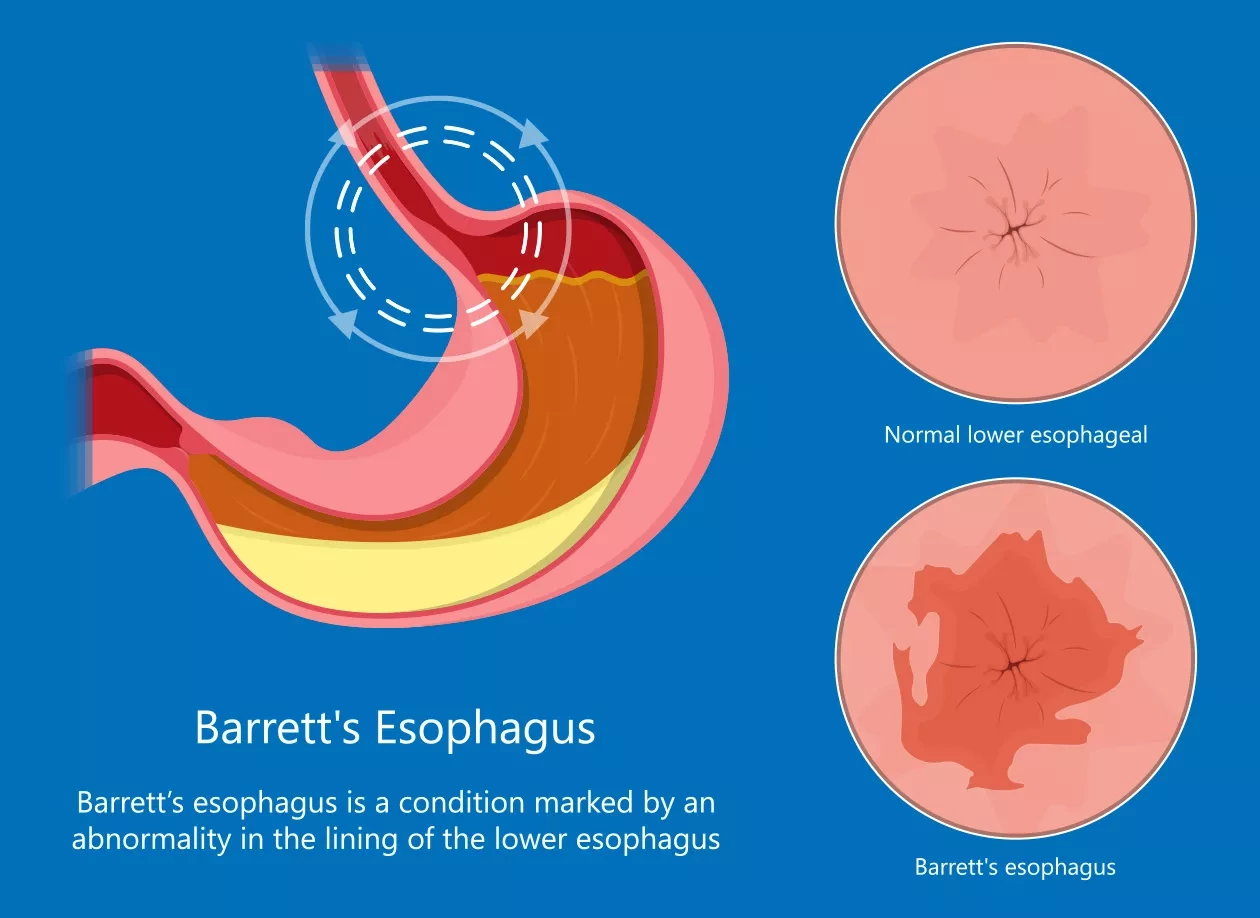
Проанализировав нормальные, предраковые и раковые образцы биоптатов с помощью секвенирования РНК, исследователи обнаружили, что почти во всех случаях аденокарциномы пищевода, а также состояния, называемого пищеводом Барретта, сигналы EphB2 гиперактивированы.
Пищевод Барретта возникает, когда слизистая оболочка пищевода повреждается в результате кислотного рефлюкса, что приводит к замене клеток пищевода клетками кишечного типа. Согласно данным Национального института здравоохранения США (NIH), это состояние связано с повышенным риском развития рака пищевода. Ученые считают, что путь EphB2 является привлекательной терапевтической мишенью, и подавление его активности в раке может стать полезной стратегией лечения этих онкологических заболеваний.
"Нашей ближайшей целью является изучение и разработка химических ингибиторов EphB2 и/или стратегий, направленных на иммунные клетки, и проверка их эффективности в доклинических моделях рака пищевода и желудка, а затем переход к испытаниям на людях", - сказал Гуда.
Srividya Venkitachalam et al. Тирозинкиназа рецептора Ephrin B2 является регулятором протоонкогена MYC и молекулярных программ, центральных для неоплазии Барретта (аннотация).
Механизмы, способствующие возникновению и прогрессированию аденокарциномы пищевода (EAC), ассоциированной с болезнью Барретта (BE), остаются неустановленными. В данном исследовании мы изучили основные сигнальные пути, дерегулированные на ранних стадиях развития неоплазии Барретта.
Методы
Анализ секвенирования РНК всего транскриптома был проведен в первичных биоптатах тканей BE, EAC, нормальной сквамозной ткани пищевода и желудка (N = 89). Компоненты отдельных путей были подтверждены методом qPCR в независимой когорте предзлокачественных и злокачественных биопсийных тканей (N = 885). Функциональное влияние выбранных путей было исследовано с помощью транскриптомного, протеомного и фармакогенетического анализов в органотипических моделях пищевода млекопитающих и клеточных линиях BE/EAC, полученных от пациентов, in vitro и/или in vivo.
Результаты
В подавляющем большинстве первичных тканей BE/EAC и моделей клеточных линий наблюдалась гиперактивация EphB2-сигнализации. Транскриптомный/протеомный анализ выявил EphB2 как эндогенного партнера по связыванию MYC связывающего белка 2 (MYCBP2) и регулятора восходящего уровня c-MYC. Нокдаун EphB2 значительно снижал жизнеспособность/пролиферацию клеток EAC и BE in vitro/in vivo. Активация EphB2 в нормальных 3D-органотипах SQ пищевода нарушала созревание эпителия и способствовала развитию программ колончатой дифференцировки, в частности, включающих MYC. EphB2 и MYC показали селективную индукцию в подслизистых железах пищевода (ESMG) с ацинарно-протоковой метаплазией, а также в свиной модели BE-подобных сфероидов ESMG. Клинически одобренные ингибиторы MEK, протеинкиназы, регулирующей MYC, эффективно подавляли рост опухоли EAC in vivo.
Выводы
Сигнализация EphB2 часто гиперактивируется в континууме BE-EAC. EphB2 является upstream-регулятором MYC, и активация оси EphB2-MYC, вероятно, предшествует развитию BE. Воздействие на EphB2/MYC может стать перспективной терапевтической стратегией для лечения этого часто рефрактерного и агрессивного рака.