Полученные данные могут помочь исследователям определить механизмы, вызывающие тяжелые заболевания.
Исследователи идентифицировали белковую "сигнатуру" тяжелой формы COVID-19, описанную в новом исследовании, опубликованном в Cell Reports Medicine.
"Нам было интересно узнать, можем ли мы определить механизмы, которые могут быть причиной смерти при COVID-19", - говорит Марсия Голдберг, изучающая взаимодействие между микробными патогенами и их хозяевами, и являющаяся старшим автором исследования. "Другими словами, почему одни пациенты умирают от этой болезни, а другие - которые, казалось бы, так же больны - выживают?".
В марте 2020 года, когда первые пациенты с симптомами COVID-19 начали поступать в отделение неотложной помощи Massachusetts General Hospital, c Голдберг связался ее коллега Майкл Филбин, директор отдела клинических исследований отделения неотложной помощи MGH и ведущий автор исследования. Филбин и Голдберг ранее начали сотрудничать с иммунологом MGH Ниром Хакоэном, в разработке методов изучения иммунного ответа человека на бактериальный сепсис. Они решили заняться новой проблемой с целью понять, как иммунная система человека реагирует на SARS-CoV-2.
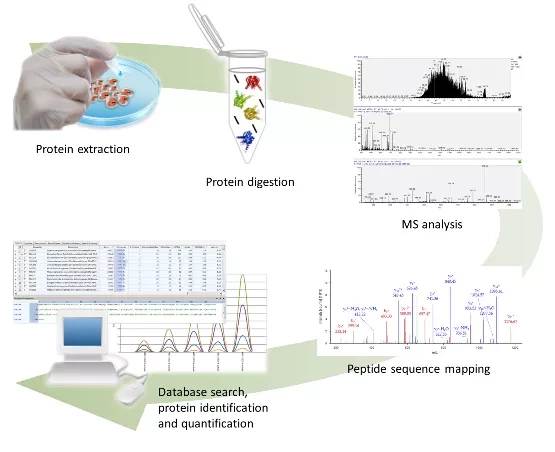
Для проведения этого исследования команда MGH использовала протеомику - анализ всего белкового состава (или протеома) клетки, ткани или организма. В данном случае протеомный анализ был использован для изучения образцов крови, взятых у пациентов, поступивших в приемный покой больницы с респираторными симптомами, соответствующими COVID-19. Для сбора этих образцов потребовалась большая группа сотрудников из многих отделов, которые затем работали в течение пяти недель, чтобы собрать образцы крови 306 пациентов с COVID-19, а также 78 пациентов с аналогичными симптомами, но с отрицательным тестом на коронавирус.
Затем к работе был привлечен Арнав Мехта, который должен был следить за интерпретацией сложных данных, полученных в результате протеомного анализа. Мехта также работает в лаборатории Хакоэна, и они оба уже давно заинтересованы в использовании протеомного анализа крови в качестве альтернативы биопсии (которая является инвазивной и болезненной). Мы задавались вопросом: "Что мы можем узнать о том, что происходит в организме, просто посмотрев на белковые сигнатуры в крови?" - говорит Мехта.
Исследование показало, что у большинства пациентов с COVID-19 имеется стабильная белковая сигнатура, независимая от тяжести заболевания; как и следовало ожидать, их организм вызывает иммунный ответ, вырабатывая белки, которые атакуют вирус. "Но мы также обнаружили небольшую группу пациентов, у которых не наблюдалось провоспалительной реакции, характерной для других пациентов с COVID-19", - говорит Филбин, - и при этом вероятность тяжелого течения заболевания у этих пациентов была такой же, как и у других. Филбин отмечает, что пациенты этой подгруппы, как правило, были пожилыми людьми с хроническими заболеваниями, у которых, вероятно, была ослаблена иммунная система.
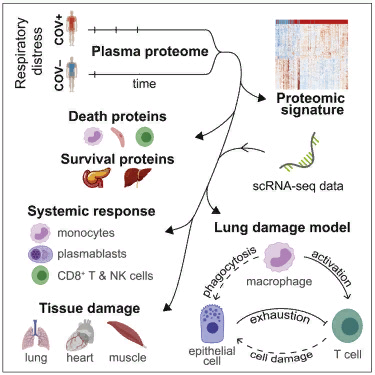
Следующим шагом было сравнение белковых сигнатур пациентов с тяжелой формой заболевания (определяемых как те, кому потребовалась интубация или кто умер в течение 28 дней после поступления в больницу) с пациентами с менее тяжелыми формами COVID-19. Это сравнение позволило исследователям выявить более 250 "связанных с тяжестью заболевания" белков. Важно, отмечает Мехта, что кровь у пациентов брали три раза (при поступлении, затем через три и семь дней). "Это позволило нам проследить траекторию развития болезни", - говорит Мехта.
Среди прочих результатов, исследование показало, что наиболее распространенный белок, связанный с тяжестью заболевания, провоспалительный белок интерлейкин-6, или IL-6, постоянно повышался у пациентов, которые затем умерли, в то время как у выживших пациентов с тяжелой формой заболевания он повышался, а затем снижался. Первые попытки других групп лечить пациентов с острым респираторным дистрессом COVID-19 препаратами, блокирующими IL-6, оказались неутешительными, хотя более поздние исследования показывают перспективность сочетания этих препаратов с дексаметазоном.
Однако Хакоэн отмечает, что многие другие белки, связанные с тяжестью заболевания, выявленные в ходе анализа, вероятно, важны для понимания того, почему только у части больных COVID-19 развиваются тяжелые случаи заболевания. По его словам, очень важно узнать, как болезнь влияет на легкие, сердце и другие органы, а протеомный анализ крови - относительно простой метод получения этой информации. "Вы можете задаться вопросом, какие из многих тысяч белков, циркулирующих в вашей крови, связаны с реальным исходом заболевания, - говорит Хакоэн, - и есть ли набор белков, которые нам о чем-то говорит".
Голдберг считает, что протеомные сигнатуры, выявленные в данном исследовании, именно это и сделают. "С большой вероятностью они могут оказаться полезными для выяснения некоторых глубинных механизмов, которые приводят к тяжелым заболеваниям и смерти при COVID-19", - говорит Голдберг, выражая благодарность пациентам, участвовавшим в исследовании. Их образцы уже используются для изучения других аспектов COVID-19, например, для определения качества антител, которые пациенты вырабатывают против вируса.
Michael R. Filbin et al. Лонгитюдный протеомный анализ тяжелой формы COVID-19 выявляет сигнатуры, связанные с выживанием, тканеспецифической гибелью клеток и взаимодействием клетка-клетка (аннотация).
Механизмы, лежащие в основе тяжелой формы COVID-19, остаются малоизученными. Мы проанализировали несколько тысяч белков плазмы крови 306 пациентов с COVID-19 и 78 контрольных пациентов с симптомами, выявив иммунные и неиммунные белки, связанные с COVID-19. Деконволюция наших данных о протеоме плазмы с использованием опубликованных наборов данных scRNA-seq выявляет вклад циркулирующих иммунных и тканевых клеток. У 16 % пациентов наблюдалось снижение воспаления, но при этом наблюдались сравнительно плохие исходы.
Сравнение пациентов, которые умерли, с выжившими тяжелобольными выявляет динамические иммунноклеточные и тканеассоциированные белки, связанные с выживанием, включая экзокринные панкреатические протеазы. Используя полученные тканеспецифические и интрацеллюлярные сигнатуры, экспрессию клеточного ангиотензин-конвертирующего фермента 2 (ACE2) и наши данные, мы можем сделать вывод о том, было ли повреждение органов результатом прямого или косвенного воздействия инфекции.
Мы предлагаем модель, в которой взаимодействие между миелоидными, эпителиальными и Т-клетками приводит к повреждению тканей. Эти данные дают важные сведения и представляют собой богатый ресурс для анализа механизмов тяжелой формы COVID-19.