Боль - это непрекращающийся симптом рака, который может сломать жизнь пациента.
На протяжении десятилетий исследователи полагались на опиоиды для облегчения боли, но при этом пытались найти альтернативное решение из-за побочных эффектов препаратов, но безрезультатно. Недавно исследователи из Китайского университета Гонконга обнаружили новый механизм, который, по их словам, может быть в центре возникновения боли при раке.
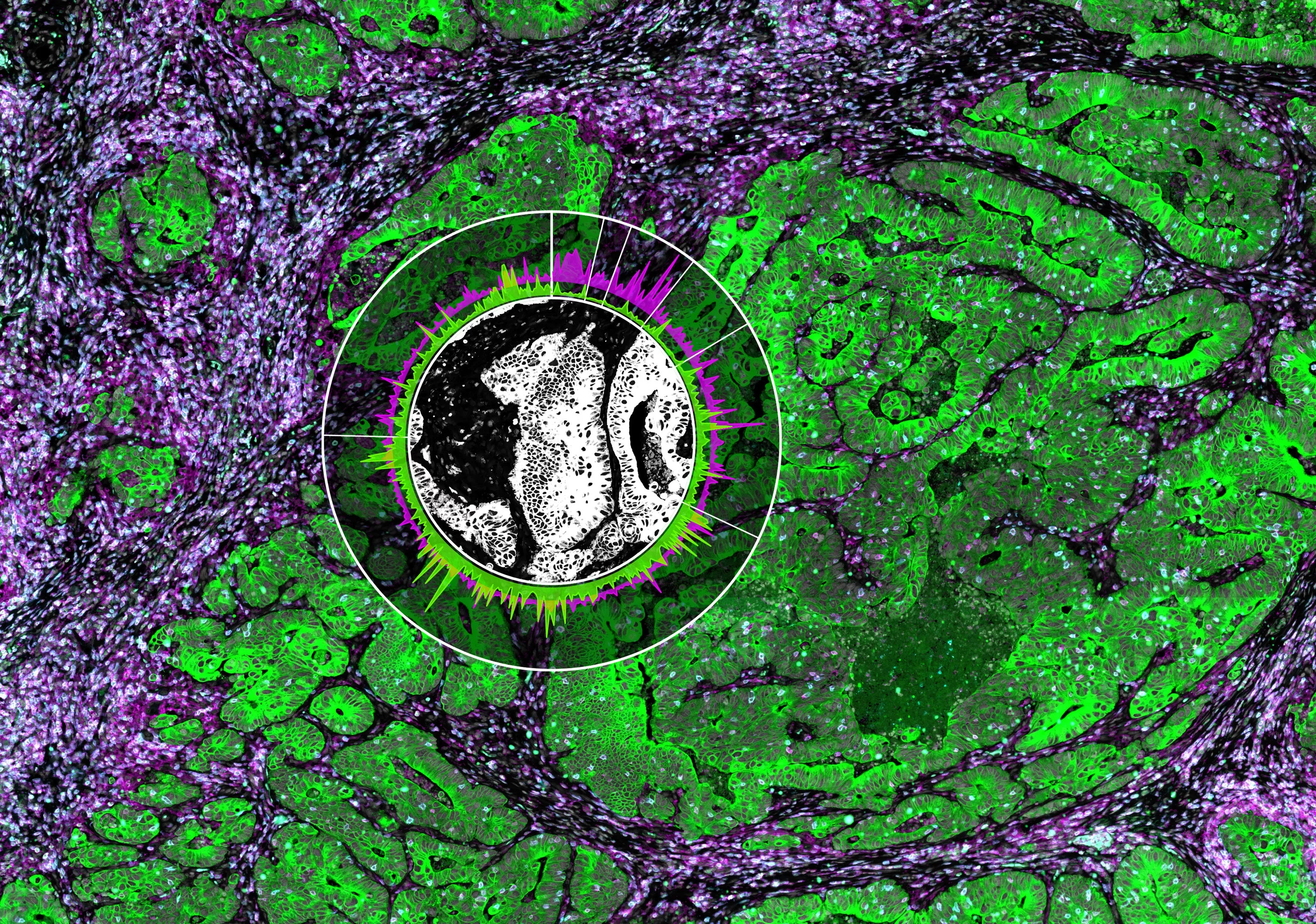
Они обнаружили, что макрофаги которые проникли в опухоли легких, могут начать подражать нейронам и действительно чувствовать боль. По словам Патрика Танга, биохимика и соавтора работы, это явление, названное "переходом от макрофагов к нейронам" или MNT, описанное в исследовании, опубликованном 7 октября в журнале Science Advances, дает потенциальное объяснение тому, почему некоторые раковые больные не могут найти облегчение боли с помощью обычных обезболивающих средств.
"Многие невропатические болевые состояния очень трудно поддаются лечению", - говорит Трейси Игнатовски, патолог из Университета Буффало, которая не принимала участия в данной работе. "Мы ищем новые способы более эффективного управления или облегчения боли, и [MNT] предлагает потенциально уникальную мишень для терапевтического потенциала".
Предыдущие исследования в этой области показали, что нервная иннервация играет важную роль в росте опухоли и прогрессировании рака. В попытке понять происхождение нейронов, чувствующих боль, при раке легких, Танг и его коллеги начали свое исследование с использования технологии РНК-секвенирования опухолевых клеток, полученных от мышей с раком легких. Тогда они поняли, что предполагаемые нейроны на самом деле являются нейроноподобными клетками, которые также очень похожи на макрофаги. Другие исследования показали, что макрофаги могут имитировать многие другие типы клеток, что придает достоверность новому открытию, но как клетки совершают такой переход, оставалось загадкой.
Поэтому авторы использовали иммунопреципитацию хроматина для анализа геномных изменений, которые претерпевают макрофаги, чтобы получить нейронные фенотипы. Основываясь на изменениях в экспрессии генов, которые выявил этот метод, они предположили, что транскрипционный фактор под названием SMAD3 может инициировать этот переход. И вот, когда исследователи использовали удаление генов и препараты для подавления активности SMAD3 у иммунодефицитных мышей, нейроноподобных клеток оказалось меньше, чем у контрольных мышей, и животные также демонстрировали меньше поведения, вызванного болью, такого как облизывание и вздрагивание.
Как исследователь, изучающий взаимодействие нейронов и макрофагов уже более двух десятилетий, Игнатовски говорит, что она взволнована возможностью использования этих результатов для дальнейшей работы в этой области. Однако, по ее словам, она также сомневается в том, что эти результаты будут применимы к людям и что этот же механизм имеет место в других типах рака. "В конце концов, они могут обнаружить, что макрофаги действительно могут претерпевать подобный переход к нейроноподобному фенотипу при любом заболевании в подходящих условиях", - говорит она. "Так что это то, что необходимо исследовать".
Дэниел Адамс, молекулярный биолог из биотехнологической компании Creatv MicroTech в Мэриленде, который не участвовал в исследовании, разделяет опасения Игнатовски. "Я всегда немного сомневаюсь в поспешных выводах на мышиных моделях", - сказал он. По словам Адамса, использование животных с иммунодефицитом для изучения иммунной системы противоречит интуиции. "Но нужно с чего-то начинать", - признает он, добавляя, что работа интересная и включает в себя использование многих передовых технологий, но как она будет применяться на людях, еще предстоит выяснить.
Танг и его коллеги согласны с тем, что это ограничение их работы. Но для них есть еще большее ограничение, на котором сосредоточено их внимание: "Когда мы обнаруживаем боль, мы испытываем трудности с тем, как доказать ассоциацию на мышах", - говорит Танг. По этой причине группа теперь планирует провести исследование на раковых больных, чтобы лучше понять, как новый механизм связан с болью при раке и есть ли способы управлять ею или уменьшить ее.
"Я хочу, чтобы онкологические больные чувствовали, что у них есть надежда", - говорит Танг. "Некоторые из них действительно разочарованы болью и качеством жизни. И я просто хочу, чтобы они знали, что есть кто-то, кто работает над этим".
Philip Chiu-Tsun Tang et al. Секвенирование РНК отдельных клеток выявляет нейроподобную подгруппу макрофагов, ассоциированную с болью при раке (аннотация).
Иннервация опухоли - распространенное явление с неизвестным механизмом. В данном исследовании мы обнаружили прямой механизм опухоль-ассоциированных макрофагов (TAM) для стимулирования нейрогенеза de novo через подгруппу, демонстрирующую фенотипы нейронов и экспрессию болевых рецепторов, связанных с вызванным раком ноцифензивным поведением. Эта подгруппа в изобилии встречается при аденокарциноме легких, ассоциированной с худшим прогнозом. Выясняя динамику транскриптома ТАМ с разрешением одной клетки, мы обнаружили феномен "перехода макрофагов в нейроноподобные клетки" (MNT) для прямого содействия опухолевому нейрогенезу, что подтверждается истощением макрофагов и изучением методом картирования в моделях карциномы легких. Обнадеживает то, что мы обнаружили нейронные фенотипы и активность клеток MNT (MNTs), полученных из костного мозга, in vitro. Адоптивная передача MNTs мышам NOD/SCID заметно усилила их раково-ассоциированное ноцифензивное поведение. Мы идентифицировали специфический для макрофагов Smad3 как ключевой регулятор для продвижения MNT на геномном уровне; его разрушение эффективно блокировало иннервацию опухоли и опухолезависимое ноцифензивное поведение in vivo.
Таким образом, MNT может представлять собой высокоточную терапевтическую мишень для лечения раковой боли.