Легочные макрофаги играют центральную роль в поддержании здоровья дыхательных путей.
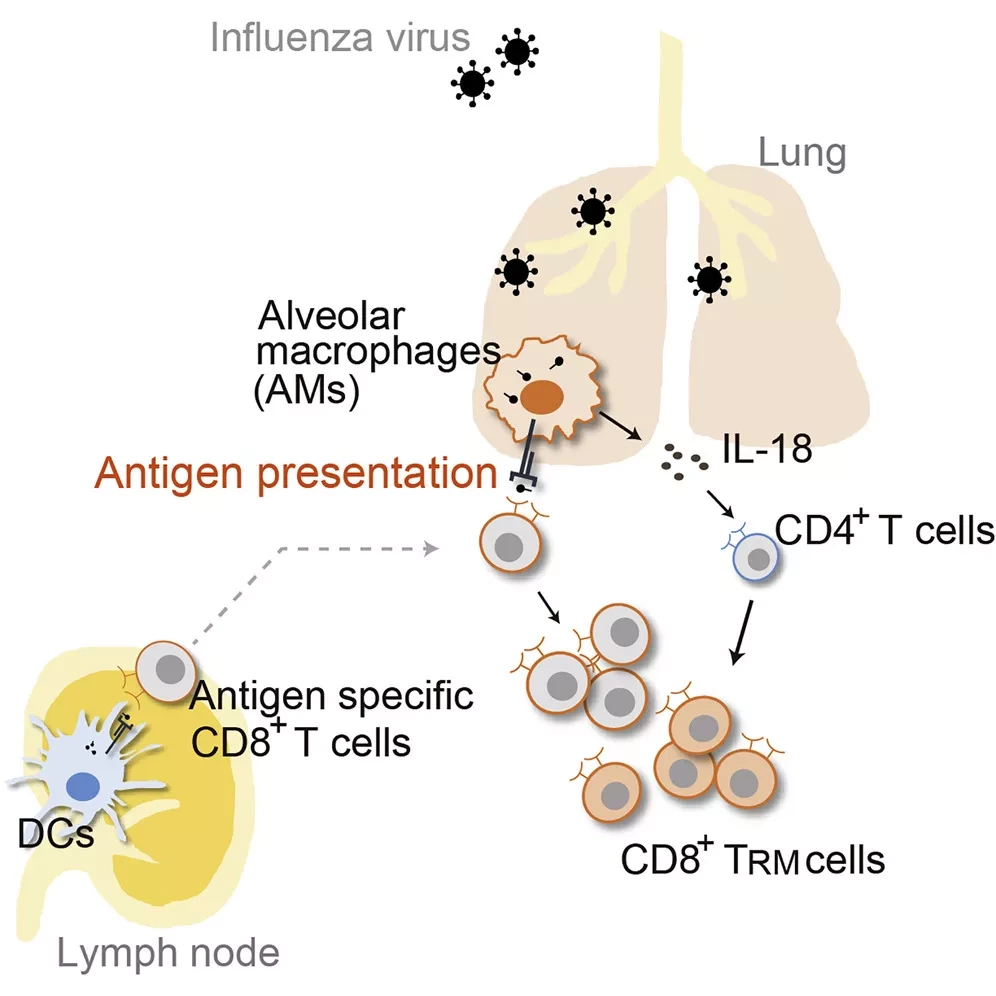
Они защищают от микроорганизмов и вдыхаемых твердых частиц и помогают в восстановлении легочной ткани. Учитывая то, насколько они важны для защиты одного из самых доступных мест проникновения патогенов, легочные макрофаги начинают проникать в ткани легких еще в утробе матери. Однако механика этого процесса во время развития плода до сих пор не известна ученым. Основным препятствием является отсутствие экспериментальной модели: использование беременных матерей в качестве испытуемых ограничено по соображениям безопасности и этики.
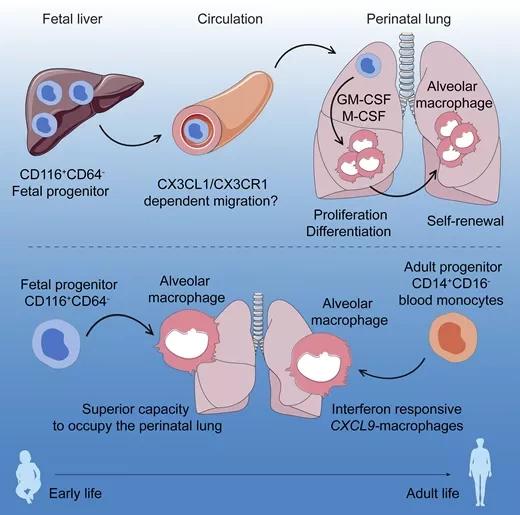
Исследователи из Каролинского института совершили прорыв в этой области. Благодаря первой в своем роде исследовательской модели с использованием генетически созданных "гуманизированных" мышей, ученые обнаружили два различных пути, участвующих в развитии легочных макрофагов. Первый включает в себя клетки-предшественники, уже присутствующие в печени развивающегося плода. Затем эти клетки-предшественники мигрируют из печени и попадают в кровоток после рождения, в конечном итоге оказываясь в своем новом доме - легких. Здесь факторы роста и другие химические сигналы запускают их созревание в специализированные легочные макрофаги.
"Второй тип развития происходит позже на протяжении жизни", - пояснил руководитель исследования Тим Виллингер. "В это время они развиваются из взрослых клеток-предшественников, моноцитов, которые находятся в крови". Имеют ли легочные макрофаги этих двух происхождений разные функции? Да, показывает исследование, в котором показано, что так называемые эмбриональные клетки-предшественники приспособлены для быстрого уничтожения вдыхаемых частиц и микроорганизмов, находящихся в воздухе. С другой стороны, легочные макрофаги, происходящие из взрослых клеток-предшественников, больше направлены на борьбу с вирусами, поскольку они сильно активируются интерфероном.
Это и другие недавние открытия в данной области расширяют наше понимание сложных механизмов развития и функционирования легочных макрофагов. Вооружившись этими знаниями, исследователи теперь могут работать над развитием клинических стратегий для лечения респираторных инфекций и других заболеваний, приводящих к повреждению легочных тканей.
Elza Evren et al. Фетальные предшественники CD116+ мигрируют в перинатальные легкие и дают начало альвеолярным макрофагам человека (аннотация).
Несмотря на их важность для здоровья и болезни легких, остается неизвестным, как развиваются альвеолярные макрофаги человека в раннем возрасте. В данном исследовании мы определяем онтогенез альвеолярных макрофагов человека из эмбриональных предшественников in vivo, используя гуманизированную мышиную модель, экспрессирующую человеческие цитокины (мыши MISTRG). Мы выявили альвеолярные макрофаги-предшественники в фетальной печени человека, которые экспрессировали рецептор GM-CSF CD116 и транскрипционный фактор MYB. Эксперименты по трансплантации мышей MISTRG позволили установить связь "предшественник - продукт" между CD34-CD116+ клетками фетальной печени и альвеолярными макрофагами человека in vivo.
Более того, мы обнаружили циркулирующие предшественники макрофагов CD116+CD64-CD115+, которые мигрировали из печени в легкие. Подобные предшественники присутствовали в легких плода человека и экспрессировали хемокиновый рецептор CX3CR1. Фетальные CD116+CD64- макрофаги-предшественники имели пролиферативную генную сигнатуру, превосходили взрослых предшественников в занятии перинатальной альвеолярной ниши и развивались в функциональные альвеолярные макрофаги.
Открытие фетальных альвеолярных макрофагов-предшественников расширяет наше понимание происхождения и онтогенеза макрофагов человека.