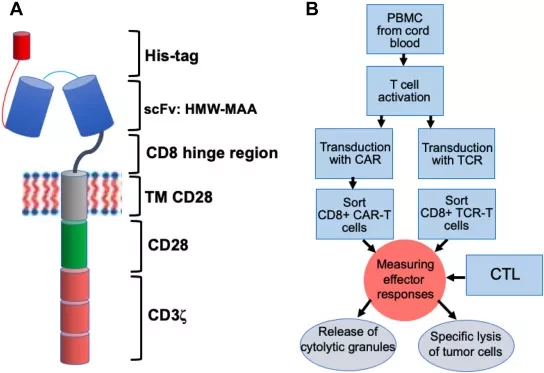
Терапия химерными антигенными рецепторами (CAR) - это иммунотерапия рака, основанная на использовании CAR, гибридных молекул рецепторов Т-клеток и антител.
Ученые создают Т-клетки пациента, экспрессирующие CAR, которые уничтожают раковые клетки, отображающие молекулы, на которые нацелен домен антитела CAR. Хотя FDA одобрило CAR T-терапию для лечения В-клеточного рака, исследователям было трудно распространить этот терапевтический подход на другие гематологические злокачественные опухоли. При Т-клеточном раке, таком как Т-клеточная лимфобластная лейкемия (ТЛЛ), эта проблема возникает из-за фратрицида - взаимного самоуничтожения CAR Т-клеток.
CAR Т-клетки часто имеют те же рецепторы, что и злокачественные Т-клетки, что приводит к фратрициду. Паулина Веласкес, клиницист-исследователь в Детской исследовательской больнице Святого Иуды, стремится преодолеть фратрицид, чтобы с помощью CAR T-терапии бороться со злокачественными Т-клетками. "Мы очень хотели разработать терапию для ТЛЛ, и это всегда вызывало интерес, поскольку хотели понять... как нацеливать Т-клетки на Т-клетки?"
В исследовании, опубликованном в журнале Blood, группа Веласкес изучила устойчивость к фратрициду и противоопухолевую активность CAR Т-клеток, полученных из подмножества Т-клеток, которые в природе не экспрессируют трансмембранный белок CD7. CD7 является привлекательной мишенью для CAR Т-терапии из-за его высокой и практически универсальной экспрессии в злокачественных Т-клетках. Однако, чтобы эффективно воздействовать на CD7-положительные раковые клетки, CAR T-клетки не должны сами экспрессировать CD7. Вместо того чтобы усложнять процесс создания CAR, нарушая работу CD7 с помощью редактирования ДНК или блокаторов экспрессии белка, команда Веласкес использовала CD7-отрицательные Т-клетки от здоровых человеческих доноров.
После того как исследователи успешно отобрали CD7-отрицательные Т-клетки, они сконструировали их так, чтобы они экспрессировали CD7-CAR (CD7-CARCD7-). Эти сконструированные клетки были устойчивы к фратрициду и проявляли мощную противоопухолевую активность как в культуре, так и в ксенотрансплантационной мышиной модели Т-клеточного острого лимфобластного лейкоза (T-ALL).
CAR T-терапия обычно разрабатывается с использованием большого количества Т-клеток, а не конкретного подмножества. Чтобы убедиться, что отобранные клетки будут уничтожать раковые клетки в достаточной степени, исследователи сравнили CAR T функции CD7-отрицательных Т-клеток с не отобранными массовыми Т-клетками. "Вы не можете сравнить, что происходит с основной массой Т-клеток [экспрессирующих CD7-CAR]... потому что они просто уничтожают друг друга", - поясняет Веласкес. Вместо этого исследователи изучили противоопухолевый потенциал CD7-отрицательных Т-клеток, экспрессирующих CD19-CAR, которые проявили противоопухолевую активность против CD19-положительных клеток рака крови, сравнимую с массовыми CD19-CAR Т-клетками. Это позволило исследователям убедиться в эффективности CAR T функции CD7-отрицательных Т-клеток.
Кроме того, в ходе клинического исследования CD19-положительного ALL группа Веласкес ретроспективно изучила долю массовых CD19-CAR Т-клеток с естественно низкой экспрессией CD7. Образцы пациентов, ответивших на терапию CD19-CAR T, имели высокую долю Т-клеток с низкой экспрессией CD7. "Это определенно удивительный аспект данного исследования", - считает Марк Мансур, клинический профессор детской гематоонкологии Университетского колледжа Лондона, который не принимал участия в исследовании. "Когда вы обычно создаете CAR T-клеточный продукт... вы фактически не выбираете какой-либо подтип [T-клеток]. По сути, отбор происходит in vivo, в организме пациента, для тех CAR T-клеток, которые, похоже, сохраняются дольше всего. И я не думаю, что специалисты оценивали, что именно эта CD7-отрицательная или CD7-низкая популяция, похоже, сохраняется лучше всего", - объяснил он.
Плохие исходы, связанные с рецидивом T-ALL, подчеркивают необходимость в новых и улучшенных вариантах лечения. CAR T-терапия помогает удовлетворить эту потребность, а встречающиеся в природе CD7-отрицательные Т-клетки могут стать решением проблемы борьбы с Т-клеточными злокачественными опухолями с помощью этой стратегии. "Больше всего нас воодушевил тот факт, что когда мы снова ввели опухоль [клетки мышам, обработанным CD7-CARCD7], они сохранили прекрасную противоопухолевую активность, чего мы не наблюдаем во многих наших моделях", - пояснила Веласкес.
Это говорит о том, что Т-клетки CD7-CARCD7 перспективны для пациентов с рецидивирующим заболеванием. Хотя на это может потребоваться время, следующие шаги в этом направлении будут направлены на то, чтобы перевести исследование в клинические условия и предоставить пациентам более эффективный вариант лечения, что крайне необходимо для улучшения исходов рецидивирующего T-ALL.
Abdullah Freiwan et al. Инженерия естественных CD7-негативных Т-клеток для иммунотерапии гематологических злокачественных опухолей (аннотация).
Химерные антигенные рецепторы (CAR) Т-клеточной терапии, направленной на Т-клеточный острый лимфобластный лейкоз (T-ALL), сталкиваются с такими ограничениями, как выбор антигена и ограниченная персистенция Т-клеток. CD7 является привлекательным антигеном для борьбы с T-ALL, но избыточная экспрессия на здоровых Т-клетках приводит к фратрициду CD7-CAR Т-клеток, что требует дополнительной генетической модификации.
Мы воспользовались преимуществами встречающихся в природе CD7- Т-клеток для создания CD7-CAR (CD7-CARCD7-)Т-клеток. CD7-CARCD7- Т-клетки демонстрировали преимущественно фенотип памяти CD4+ и обладали значительной противоопухолевой активностью при хроническом воздействии антигена in vitro и в ксенотрансплантационных моделях мышей. Основываясь на этих обнадеживающих результатах, мы изучили полезность CD7- Т-клеток для иммунотерапии CD19+ гематологических злокачественных опухолей.
Прямое сравнение неселектированных (массовых) CD19-CAR и CD19-CARCD7- Т-клеток показало, что CD19-CARCD7- Т-клетки обладают повышенной противоопухолевой активностью по сравнению с массовыми аналогами in vitro и in vivo. Наконец, чтобы получить представление о поведении CD19-CAR Т-клеток с низким уровнем экспрессии гена CD7 (CD7lo) у пациентов, мы собрали базы данных по экспрессии генов и Т-клеточных рецепторов (TCR) в одной клетке из нашего институционального клинического исследования CD19-CAR Т-клеток. Т-клетки CD19-CARCD7lo присутствовали в исходном продукте Т-клеток CD19-CAR и могли быть обнаружены после введения. Интересно, что единственный функциональный кластер CD4+ CD19-CAR Т-клеток, наблюдаемый после введения, демонстрировал экспрессию CD7lo. Кроме того, в образцах пациентов, ответивших на терапию, доля CD7lo Т-клеток была выше, чем в образцах пациентов, не ответивших на терапию.
Таким образом, CARCD7- Т-клетки обладают благоприятными биологическими характеристиками и могут представлять собой перспективное подмножество Т-клеток для адоптивной клеточной терапии T-ALL и других гематологических злокачественных опухолей.