Ученые из Университета Иллинойса в Чикаго проанализировали данные экспрессии генов более чем 35 000 клеток кровеносных сосудов из легких мышей и выделили два подтипа.
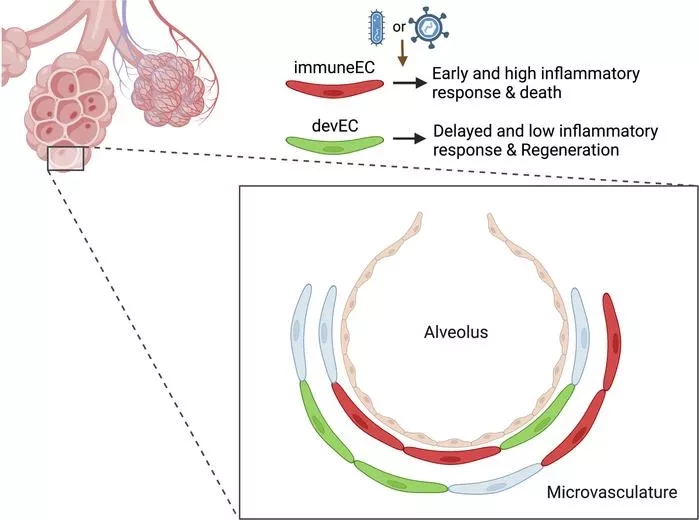
Один подтип, который они назвали иммунными эндотелиальными клетками, или immuneECs, преимущественно экспрессировал больше генов, вовлеченных в воспаление и регуляцию иммунного ответа. Подтип devEC, или эндотелиальные клетки развития, экспрессировал больше генов, участвующих в процессах развития клеток, таких как регенерация и пролиферация. Результаты исследования опубликованы в журнале JCI Insight. Они могут привести к улучшению лечения легочных инфекций, которые могут опасно усугубляться из-за неконтролируемого воспаления.
Авторы во главе с Джалисом Рехманом классифицировали подтипы, извлекая легочную ткань мышей, модифицированных для экспрессии флуоресцентного белка только в эндотелиальных клетках кровеносных сосудов. Используя сортер клеток, ученые выделили эндотелиальные клетки легких. Затем они провели секвенирование РНК тысяч отдельных эндотелиальных клеток и распределили их по категориям на основе их отличительных генных сигнатур. Они обнаружили множество групп эндотелиальных клеток, с двумя доминирующими типами клеток - иммунные клетки (immuneECs) и клетки развития (devECs), которые менялись со временем в процессе воспаления.
"Во всех наших экспериментах мы постоянно наблюдали, что клетки кровеносных сосудов легких имеют различные функции и группируются, а две преобладающие группы становятся еще более различимыми при реакции на инфекцию или стресс", - рассказывает Рехман. "Важно отметить, что мы также проанализировали общедоступные базы данных легких человека и обнаружили такие же отдельные группы эндотелиальных клеток, которые мы наблюдали в легких мышей".
В своих экспериментах Рехман и его коллеги изучали клетки мышей со здоровыми легкими и мышей с легкими, которые были травмированы или боролись с инфекциями, вызванными бактериальным токсином или вирусом гриппа. Хотя оба подтипа присутствовали в здоровых и больных легких, профили экспрессии генов каждого подтипа еще больше расходились в ответ на инфекции или травмы.
По мере прогрессирования заболевания или травмы immuneECs экспрессировали больше генов иммунного ответа, например, гены основного комплекса гистосовместимости, которые служат маяком для Т-клеток. По мере улучшения состояния легких, devECs экспрессировали больше генов восстановления, например, ген развития сосудов Sox17, который способствует росту и регенерации кровеносных сосудов. Проанализировав профили РНК эндотелиальных клеток легких, полученных от приматов с инфекцией SARS-CoV-2, исследователи также обнаружили различные группы эндотелиальных клеток легких.
"Часть эндотелиальных клеток кровеносных сосудов становится подверженной сильному воспалению, а часть сохраняет способность к регенерации", - сказал Рехман. "Наши данные также свидетельствуют о том, что через некоторое время развивающийся подтип, который, по сути, готов к регенерации, дает начало клеткам, которые начинают пролиферировать и восстанавливать кровеносные сосуды, поврежденные во время инфекции".
Ученые говорят, что понимание баланса между подтипами и использование этого разделения функций может привести к целенаправленному лечению заболеваний, затрагивающих кровеносные сосуды легких, таких как острый респираторный дистресс-синдром, возникающий при тяжелых легочных инфекциях. При этих инфекциях immuneECs могут играть ключевую роль в активации начального иммунного ответа, необходимого для борьбы с патогенами. Однако при тяжелых инфекциях иммунная система может отреагировать слишком остро и начать повреждать собственную легочную ткань, даже когда вирус или бактерии будут уничтожены.
"Это исследование указывает нам на то, что если мы хотим лечить кровеносные сосуды легких, мы должны целенаправленно воздействовать на тот подтип, который выходит из равновесия. Если иммунный ответ чрезмерен, как это часто бывает при тяжелой форме COVID-19, возможно, важно подавить активность иммунных регуляторных эндотелиальных клеток, одновременно усиливая рост регенеративных эндотелиальных клеток", - говорит Рехман. "Понимая, что клетки кровеносных сосудов имеют такие разные функции, мы можем работать над терапией, которая будет направлена больше на один тип клеток кровеносных сосудов по сравнению с другим типом клеток кровеносных сосудов".
По словам Рехмана, результаты исследования являются хорошим напоминанием о том, что наши легкие всегда находятся в контакте с внешним миром, и, возможно, именно поэтому легочным кровеносным сосудам необходим такой тонкий баланс между подтипами эндотелиальных клеток, которые могут активировать или усиливать иммунный ответ, в то время как другие эндотелиальные клетки могут помочь восстановить кровеносные сосуды после того, как инфекция начнет стихать.
"Мы постоянно вдыхаем патогены, тогда как другие органы, такие как сердце или мозг, гораздо более защищены от патогенов внешнего мира. Вот почему в легких так важен баланс, эта сложная система, включающая как воспалительную, так и восстановительную реакцию", - отметил Рехман.
Lianghui Zhang et al. Транскриптомное профилирование единичных клеток эндотелия легких выявляет динамические воспалительные и регенеративные субпопуляции (аннотация).
Исследования продемонстрировали фенотипическую гетерогенность эндотелиальных клеток сосудов (ECs) в пределах сосудистого русла; однако мало что известно о том, как различные субпопуляции эндотелия в конкретном органе реагируют на воспалительный стимул.
Мы провели РНК-секвенирование 35 973 легочных EC, полученных в исходном состоянии, а также в постинъекционные временные точки после воспалительного повреждения легких, вызванного воздействием LPS. Кластеризация Сеурата и анализ путей экспрессии генов выявили 2 основные субпопуляции в эндотелии микрососудов легких: субпопуляцию, обогащенную экспрессией генов иммунного ответа, таких как гены MHC (immuneEC), и другую, определяемую повышенной экспрессией генов развития сосудов, таких как Sox17 (devEC). Наличие субпопуляций immuneEC и devEC также наблюдалось в легких приматов, инфицированных вирусом SARS-CoV-2, и в легких мышей, инфицированных вирусом гриппа H1N1. После пика воспалительного повреждения мы наблюдали появление пролиферативной субпопуляции легочных EC. Сверхэкспрессия Sox17 предотвращала воспалительную активацию в ECs.
Таким образом, в эндотелии микрососудов легких, по-видимому, существует "разделение функций", при котором одни EC проявляют склонность к воспалительной сигнализации, а другие - к регенерации эндотелия. Эти результаты дают основания для разработки целевой терапии, направленной на ограничение воспалительного повреждения легких и содействие регенерации.