Исследователи из Массачусетской больницы общего профиля (MGH) обнаружили, что сигнальный путь рецептора интерферона гамма (IFNgR) имеет решающее значение для восприимчивости опухолей глиобластомы к уничтожению иммунотерапией CAR T-клетками.
Такое же явление наблюдалось и в других солидных опухолях. Это открытие может частично объяснить, почему гемобластозы и солидные опухоли по-разному реагируют на лечение CAR T-клетками. Исследование опубликовано в статье в журнале Nature.
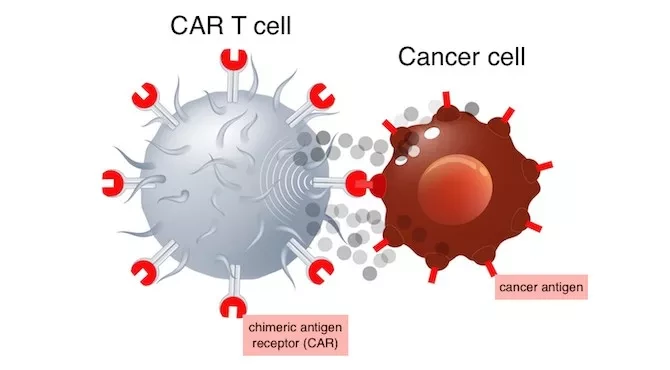
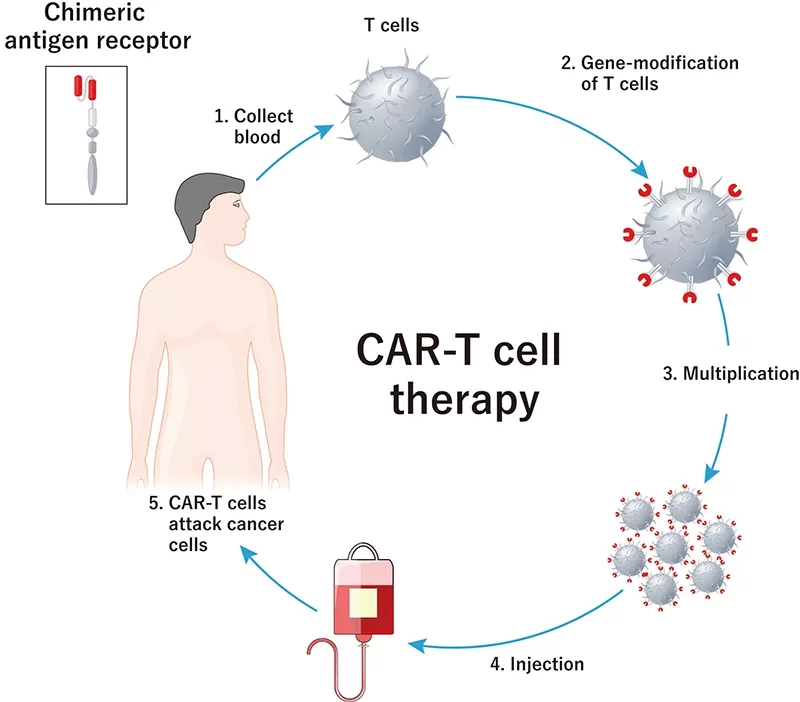
Химерный антигенный рецептор (CAR) - это любая синтетическая молекула, которая специально приказывает Т-клеткам иммунной системы распознать и прикрепиться к мишени, или антигену. CAR распознают мишени, находящиеся на поверхности опухолевых клеток. Хотя CAR-терапия оказала преобразующее воздействие на лечение гематологических раков, таких как лейкемия и лимфома, она не привела к аналогичному успеху в лечении солидных опухолей.
Для выявления путей развития резистентности в солидных опухолях исследователи разработали геномный скрининг CRISPR-нокаутов в глиобластоме. "С помощью CRISPR-скрининга мы смогли исследовать весь геном в объединенном формате совершенно беспристрастно, а не искать один или два интересующих нас гена за один раз", - объясняет первый автор Ребекка Ларсон. Это позволило исследователям увидеть, какие гены утрачены, и определить механизмы резистентности, которые используют солидные опухоли, чтобы уклониться от терапии CAR T-клетками. В этом исследовании они применили селективное давление с помощью CAR к каждой клетке со штрих-кодом в скрининге. "Затем мы провели секвенирование клеток и увидели, какие опухолевые клетки были живыми, что позволило нам определить, какие гены были нокаутированы".
Когда Ларсон и ее коллеги применили этот скрининг к нескольким клеточным линиям глиобластомы, включая несколько клеточных линий, полученных от пациентов, они неожиданно обнаружили, что потеря генов в сигнальном пути интерферона гамма делает их резистентными к уничтожению CAR Т-клетками. "Это означает, что гены, связанные с интерфероном гамма, необходимы для того, чтобы опухоль погибла под воздействием CAR, чего мы раньше не знали и не ожидали", - добавляет Ларсон.
Эта же модель резистентности была обнаружена in vivo в моделях мышей с нокаутом. Дальнейшие исследования других типов солидных опухолей, включая линии клеток поджелудочной железы, яичников и легких, показали то же самое: устойчивость к терапии CAR T-клетками была вызвана потерей генов пути интерферона гамма.
"Мы обнаружили, что CAR T-клетки не связываются с клетками глиобластомы, в которых отсутствует сигнальный путь интерферона гамма", - поясняет Ларсон, добавляя, что хотя интерферон гамма не убивает рак напрямую, он делает опухолевые клетки более адгезивными. "Таким образом, CAR T-клетки могут лучше связываться с ними и уничтожать раковую клетку".
И наоборот, исследователи заметили, что путь интерферона гамма не играет роли в чувствительности лейкемии, лимфомы или множественной миеломы к терапии CAR T-клетками. "Тот факт, что мы можем видеть, как солидные опухоли и гемобластозы по-разному реагируют на CAR T-клеточную терапию, очень информативен для разработки будущей терапии".
По словам Ларсон, это открытие дает исследователям возможность клинического применения по двум направлениям. Во-первых, усиление связывающих взаимодействий между Т-клетками и опухолевыми клетками путем воздействия на путь интерферона гамма может привести к улучшению ответов на терапию CAR T-клетками при солидных опухолях. Во-вторых, блокирование этого пути при гемобластозах может помочь уменьшить хорошо известную токсичность терапии CAR T-клетками, известную как синдром высвобождения цитокинов.
"Несмотря на то, что лечение CAR T-клетками в некоторых случаях может быть удивительно эффективным: при некоторых гемобластозах частота излечения составляет более 40%, токсичность вызывает реальную обеспокоенность", - добавляет она. "Уменьшение дозы интерферона гамма в этих раковых опухолях может сохранить эффективность, но уменьшить "американские горки" токсичности".
Rebecca C. Larson et al. Для уничтожения CAR T-клеток требуется путь IFNγR в солидных опухолях, но не гемобластозах (аннотация).
Терапия химерными антигенными рецепторами (CAR) оказала преобразующее влияние на лечение гематологических злокачественных опухолей, однако она показала ограниченную эффективность в отношении солидных опухолей. Солидные опухоли могут иметь присущие клеткам механизмы резистентности к цитотоксичности CAR T-клеток.
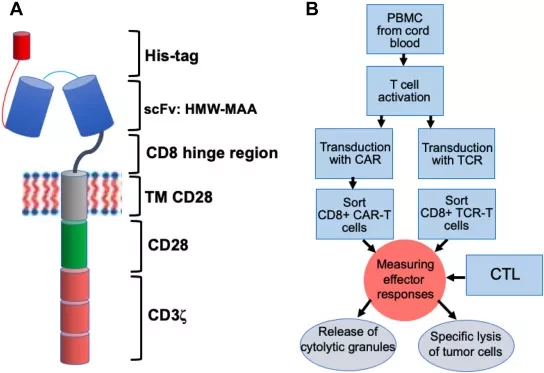
В данном исследовании для систематического выявления потенциальных путей резистентности непредвзятым образом мы провели скрининг геномных нокаутов CRISPR в глиобластоме - заболевании, при котором CAR T-клетки показали ограниченную эффективность8. Мы обнаружили, что потеря генов в сигнальном пути рецептора интерферона-γ (IFNγR) (IFNGR1, JAK1 или JAK2) делает глиобластому и другие солидные опухоли более устойчивыми к уничтожению CAR T-клетками как in vitro, так и in vivo. Однако утрата этого пути не делала клеточные линии лейкемии или лимфомы нечувствительными к CAR T-клеткам.
Используя транскрипционное профилирование, мы определили, что клетки глиобластомы, лишенные IFNγR1, имели пониженную регуляцию путей клеточной адгезии после воздействия CAR T клеток. Мы обнаружили, что потеря IFNγR1 в клетках глиобластомы снижает общую продолжительность связывания CAR Т-клеток и их авидность. Критическая роль сигнализации IFNγR в восприимчивости солидных опухолей к CAR Т-клеткам удивительна, учитывая, что CAR Т-клетки не требуют традиционных путей антигенной презентации. Напротив, в опухолях глиобластомы сигнализация IFNγR была необходима для достаточной адгезии CAR T-клеток для обеспечения продуктивной цитотоксичности.
Наша работа демонстрирует, что гемобластозы и солидные опухоли отличаются по своему взаимодействию с CAR Т-клетками, и предполагает, что усиление связывающих взаимодействий между Т-клетками и опухолевыми клетками может привести к улучшению ответа при солидных опухолях.