При многих нейродегенеративных заболеваниях, таких как болезнь Паркинсона, белковые агрегаты образуются в мозге и, как предполагается, способствуют гибели нейронных клеток.
Тем не менее, существует клеточный защитный механизм, который противодействует этим агрегатам, известным как амилоидные фибриллы, и может даже растворять уже сформированные агрегаты. Этот защитный механизм основан на активности молекулярных шаперонов из семейства белков Hsp70. Молекулярные биологи из Хайдельбергского университета и Немецкого центра исследования рака изучили, как система Hsp70 дезагрегирует амилоидные фибриллы Паркинсон-специфического белка в эксперименте. Исследовательская группа под руководством Бернда Букау ожидает, что результаты их исследований дадут новое представление о том, как развивается болезнь Паркинсона и что можно сделать, чтобы повлиять на нее. Результаты были опубликованы в журнале Nature.
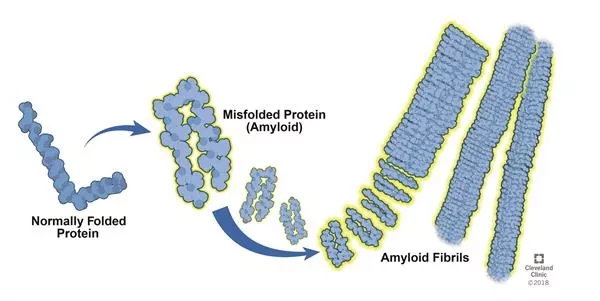
Белки во всех клетках - от бактерий до человека - должны иметь нативную пространственную структуру. Цепочки аминокислотных строительных блоков складываются в специфические трехмерные структуры, которые придают белкам их функциональность. Это состояние правильного пространственного складывания постоянно находится под угрозой внешних и внутренних воздействий, которые могут привести к неправильному сложению и, следовательно, повреждению белков. Существует опасность того, что поврежденные белки будут "агрегироваться" или слипаться в более длинные волокна - амилоидные фибриллы. Это происходит, например, с белком синуклеином при болезни Паркинсона. "Фибриллы, в свою очередь, являются отправной точкой для еще больших скоплений. Процесс образования таких фибриллярных агрегатов может повредить клетки и даже привести к их гибели, как это происходит при нейродегенеративных заболеваниях, таких как болезнь Паркинсона и болезнь Альцгеймера", - объясняет Букау.
Исследования профессора Букау сосредоточены на том, как эти белковые агрегаты могут быть разрушены. В ранней работе ему и его команде удалось определить клеточную активность, которая играет жизненно важную роль в растворении фибриллярных агрегатов, которая основана на шаперонах семейства Hsp70. Шапероны Hsp70 помогают другим белкам в пространственном складывании и могут даже изолировать и распаковать агрегированные белки. Последние исследования Букау показывают влияние шаперонов Hsp70 на специфические для Паркинсона амилоидные фибриллы белка синуклеина. Синуклеин - это небольшой белок, который помогает в высвобождении нейротрансмиттеров, хотя его точная функция остается неясной. Он стал известен, потому что массивные отложения этого специфического белка были найдены у пациентов с болезнью Паркинсона и были причинно-следственно связаны с этой болезнью.
В ходе биохимических экспериментов ученые недавно смогли показать, что человеческий Hsp70-шаперон полагается на помощь двух конкретных белков, сопровождающих растворение амилоидных фибрилл белка синуклеина. Точно отрегулированное взаимодействие этих белков приводит к образованию на поверхности фибрилл комплексов шаперонов, которые затем распадаются на агрегаты. "Именно локальное накопление многих белков-шаперонов на поверхности синуклеиновых фибрилл создает силу для разрушения фибрилл и отсоединения синуклеиновых молекул ", - объясняет Букау. Скопление шаперонов на ограниченной поверхности фибрилл играет решающую роль в создании достаточно сильных тяговых сил для разрушения фибрилл.
Второе исследование, опубликованное в журнале Nature, посвящено ранее неизвестному регулирующему механизму - типу молекулярного переключателя, который приводит в движение общую активность шаперона Hsp70 для растворения амилоидных фибрилл. Этот механизм основан на последовательности прямых взаимодействий между различными частями ко-шаперона DNAJB1 и шаперона Hsp70. В конечном итоге это активирует Hsp70 для использования АТФ в качестве источника энергии, что позволяет продуктивно связываться с фибриллами и влиять на их распад.
"Последние результаты двух исследований дают нам молекулярное понимание того, как растворяются амилоидные фибриллы. Мы смогли продемонстрировать, что шапероны работают как машина для растворения фибрилл", добавляет профессор Букау. По словам исследователя это открывает новые возможности для разработки агентов, активирующих клеточный защитный механизм на основе шаперонов против образования амилоидов. Таким образом, лучшее понимание того, как деятельность шаперона влияет на течение нейродегенеративных заболеваний, будет иметь существенное значение в терапевтическом использовании результатов.