На дворе 2540 год, и люди стали бесплодными. Человеческие эмбрионы выращиваются на фабриках, где ими манипулируют и создают условия для развития заранее определенных способностей и внешности.
Чтение в детстве "Дивного нового мира" Олдоса Хаксли и подобных антиутопических романов вызвало интерес к возможностям и опасностям инструментов манипулирования геномом у молодого Брайана Брауна, который сейчас является директором Института геномики в Медицинской школе Икан при больнице Маунт-Синай. "Тип мышления, который используют писатели-фантасты, также важен для ученых: каковы пределы человеческих знаний и технологий, и как мы можем разработать что-то, чтобы преодолеть их?", - говорит Браун.
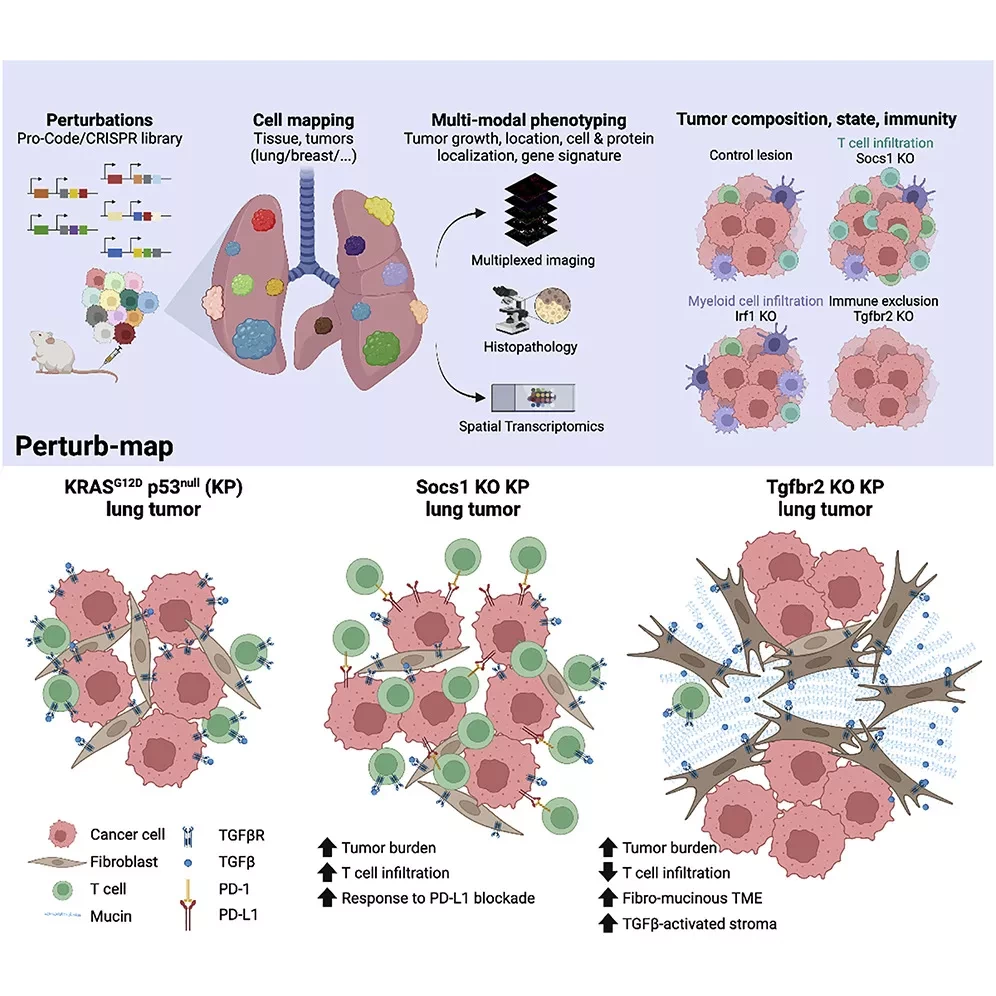
Преодоление этих границ является движущей силой карьеры Брауна; генетик разработал технологии, которые улучшают методы редактирования генов, секвенирования и генной терапии. Perturb-map, последнее изобретение Брауна, описанное в журнале Cell, добавляет еще один инструмент в арсенал исследователей рака. С помощью этой технологии редактирования генов ученые могут моделировать гетерогенность опухоли in vivo и изучать ее последствия для других типов клеток, таких как иммунные клетки или интерстициальные клетки. Таким образом, Perturb-map имеет большие перспективы для раскрытия важных аспектов биологии рака, включая эволюцию раковых клеток и реакцию пациентов на лечение.
Появление технологии CRISPR революционизировало возможности ученых быстро изменять большие массивы генов и изучать последствия для функционирования клеток. Объединенные скрининги CRISPR, в которых ученые используют библиотеку CRISPR-индуцирующих векторов для манипулирования различными генами в различных клетках ткани, помогли выявить огромное количество генов с важными функциями в различных процессах, связанных с раком, включая активацию иммунных клеток и сигнальные пути рака.
Хотя объединенные CRISPR-скрининги являются мощным инструментом, Браун почувствовал себя стесненным некоторыми ограничениями этой технологии. Чтобы выявить CRISPR-индуцированные манипуляции и связать их с изменениями в поведении клетки, ученые должны диссоциировать ткань и провести секвенирование единичных клеток вместе с другими технологиями фенотипирования единичных клеток, такими как проточная цитометрия. Эти физические манипуляции не позволяют ученым изучать функции генов, выходящие за пределы клеточной мембраны. "Дело не только в том, что вы не найдете гены с очевидными внеклеточными функциями, например, цитокины, но и в том, что вы не найдете последующие функции гена, связанные с внеклеточной функцией", - говорит Браун.
Чтобы преодолеть это ограничение, Браун разработал Perturb-map - метод скрининга CRISPR, который сохраняет пространственную информацию о ткани, чтобы ученые могли изучить последствия манипуляции для редактируемой клетки и ее соседей. Он создал систему для визуальной идентификации отдельных CRISPR-редактированных клеток с помощью экспрессии репортерных генов. Таким образом, ученые могут сочетать мультиплексную иммуногистохимию с другими технологиями фенотипирования, такими как пространственная транскриптомика, для выявления и анализа мутантных клеток в их родной среде. "Технология позволяет изучать различные мутантные клоны в организме одной мыши. Она прекрасно контролируется изнутри в очень изменчивой системе", - отметил Бенджамин Изар, доцент Колумбийского университета, который не принимал участия в исследовании.
Чтобы продемонстрировать потенциал технологии, исследовательская группа Брауна провела пространственный функциональный геномный скрининг у мышей, отключая любой из 35 различных генов в отдельных клетках рака легких, чтобы создать небольшие очаги мутантных клонов. Исследователи проанализировали более 200 мутантных клонов по каждому целевому гену, оценивая влияние каждого нарушения на клеточные функции, инфильтрацию иммунных клеток, развитие сосудов и многое другое, чтобы раскрыть внутриклеточные и внеклеточные функции соответствующего гена.
Когда Браун проанализировал инфильтрацию иммунных клеток в различных мутантных клонах, он был поражен различиями между соседними клетками. "Эти клетки имеют одинаковые антигены, и они находятся рядом друг с другом. И все же, Т-клетки проникают в [один мутантный клон], но не могут мигрировать в [соседний мутантный] очаг поражения, представляя собой потенциальные очаги резистентности", - рассказал он. Эти результаты показывают потенциал Perturb-map для выявления генетических детерминант реакции пациентов на иммунотерапию, и это дивный новый мир, который Браун собирается исследовать дальше.
Maxime Dhainaut et al. Пространственная CRISPR-геномика выявляет регуляторы микроокружения опухоли (аннотация).
В то время как CRISPR-экраны помогают обнаружить гены, регулирующие многие внутриклеточные процессы, существующие подходы являются неоптимальными для выявления внеклеточных функций генов, особенно в тканевом контексте.
В данном исследовании мы разработали подход для пространственной функциональной геномики под названием Perturb-map. Мы применили Perturb-map для параллельного нокаута десятков генов в мышиной модели рака легких и одновременно оценили, как каждый нокаут влияет на рост опухоли, гистопатологию и иммунный состав. Более того, мы сопрягли Perturb-map с пространственной транскриптомикой для объективного анализа CRISPR-редактированных опухолей. Мы обнаружили, что в опухолях с нокаутом Tgfbr2 микроокружение опухоли (TME) было преобразовано в фибро-муцинозное состояние и исключены Т-клетки, одновременно с повышением уровня TGFβ и TGFβ-опосредованной активацией фибробластов, что указывает на то, что потеря TGFβ-рецепторов на раковых клетках увеличила биодоступность TGFβ и его иммуносупрессивное воздействие на TME.
Эти исследования позволяют использовать Perturb-map для функциональной геномики внутри ткани с разрешением в одну клетку с сохранением пространственной архитектуры и дают представление о том, как TGFβ-реактивность раковых клеток может влиять на ТМЕ.